Hiện tượng điện phân
a/Định nghĩa hiện tượng điện phân:
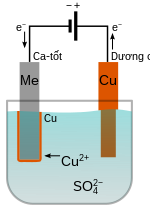
Hiện tượng điện phân là hiện tượng xuất hiện các phản ứng phụ ở các điện cực khi cho dòng điện một chiều qua bình điện phân.
b/Công thức Faraday về chất điện phân
Chú thích:
: khối lượng của chất được giải phóng ra ở điện cực khi điện phân
: số Faraday
: khối lượng mol nguyên tử của nguyên tố
: hóa trị của nguyên tố
: cường độ dòng điện trong dung dịch điện phân
: thời gian điện phân
c/Ứng dụng:
Hiện tượng điện phân có nhiều ứng dụng trong thực tế sản xuất và đời sống như luyện kim, tinh luyện đồng, điều chế clo, xút, mạ điện, đúc điện,...
1. Luyện nhôm
Bể điện phân có cực dương là quặng nhôm nóng chảy, cực âm bằng than, chất điện phân là muối nhôm nóng chảy, dòng điện vào khoảng 10000A.

2. Mạ điện
Bể điện phân có cực dương là một tấm kim loại để mạ, cực âm là vật cần mạ, chất điện phân thường là dung dịch muối kim loại để mạ. Dòng điện được chọn một cách thích hợp để đảm bảo chất lượng của lớp mạ.
Michael Faraday (1791 - 1867)